ВВЕДЕНИЕ
Хроническими заболеваниями пародонта страдает большинство взрослого населения. Применяемые способы терапии включают удаление микробной биопленки путем профессиональной чистки, мероприятия по улучшению гигиены полости рта, назначение противовоспалительной системной и/или локальной лекарственной терапии. Большинство пациентов в дальнейшем нуждаются в хирургическом, ортодонтическом лечении, ортопедической реабилитации. Однако к моменту достижения стойкой ремиссии ткани пародонта, цемент, волокна периодонтальной связки и альвеолярная кость подвергаются необратимым деструктивным изменениям. Регенерация этих трех типов ткани остается серьезной проблемой. Приведен клинический случай лечения хронического генерализованного пародонтита, в ходе которого после разрешения воспалительной реакции в тканях пародонта проведен курс регенеративной терапии инъекционными препаратами «Сферо®ДЕНТ» на основе гидролизата коллагена, позволивший не только улучшить трофику тканей, но и подготовить их к дальнейшему ортодонтическому лечению.
ХРОНИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПАРОДОНТА: КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ, ЭТИОЛОГИЯ, ДИАГНОСТИКА
Большинство заболеваний пародонта связаны с развитием воспалительного процесса, инициируемого анаэробными бактериями, которые вызывают иммунный ответ хозяина через сложные молекулярные пути с участием провоспалительных медиаторов (цитокинов, факторов роста, металлопротеаз и их ингибиторов). Клиническими признаками реализации данного патологического каскада становятся:
- над- и поддесневые мягкие и твердые назуб-ные отложения;
- воспаление десен в виде гиперемии, отека, кровоточивости;
- увеличение глубины пародонтальных карма-нов и появление в них экссудата, в том числе гнойного;
- патологическая подвижность зубов, деформа-ция их рядов и формирование супраконтактов.
Специфическими мишенями патологического процесса становятся цемент, периодонтальные связки, внеклеточный матрикс десен, костная ткань зубных альвеол, которые подвергаются дистрофии, затем дезорганизации и резорбции.
В норме пародонт как комплекс тканей десны имеет бледно-розовый цвет и в редких случаях может включать очаги пигментации [1]. Он плотно прилегает к подлежащим тканям, в том числе к зубам. Край десны располагается на цементно-эмалевой границе, имеет фестончатую конфигурацию с наивысшей точкой в межзубных промежутках (так называемый межзубный сосочек) и с нижней точкой в щечной и язычной областях. В месте примыкания к зубу присутствует десневая щель, глубина которой не превышает 1–3 мм. Ее содержимое – небольшое количество интерстициальной жидкости, при этом боковая ее стенка представляет собой свободный десневой край [2].
Общая распространенность заболеваний пародонта у лиц старше 40 лет достигает 98%.
Основными этиологическими факторами повреждения пародонта являются опосредованные хозяином воспалительные и иммунные реакции в ответ на накопление микробного налета и его диффундирующих ферментов, образ жизни (вредные привычки, особенности диеты) [3, 4] и системные заболевания (сахарный диабет, атеросклероз, остеопороз) [5].
Стандартные подходы в диагностике заболеваний пародонта включают определение степени патологической подвижности зубов, исследование пародонтальных карманов с помощью зонда, расчет индекса гигиены полости рта и лучевые методы (ортопантомографию, радиовизиографию). В ряде случаев целесообразно провести цитологическое и/или микробиологическое исследование содержимого пародонтальных карманов [6].
ЛЕЧЕНИЕ ХРОНИЧЕСКОГО ПАРОДОНТИТА
Основные приемы стандартного лечения пародонтита – ликвидация микробной биопленки путем профессиональной чистки зубов, мероприятия по улучшению гигиены полости рта, противовоспалительная системная и/или локальная лекарственная терапия [7]. Позже, как правило, необходимы хирургическое или ортодонтическое лечение, ортопедическая реабилитация, направленные на восстановление структуры и функции зубочелюстной системы. К сожалению, к моменту достижения стойкой ремиссии ткани пародонта нередко подвергаются необратимым деструктивным изменениям, и их регенерация представляет собой серьезную проблему, которая до сегодняшнего дня до конца не решена.
Для стимуляции процессов остеогенеза применяют костную ткань [8], каркасы [9], стволовые клетки [10] и факторы роста. Для васкуляризации и регенерации пародонта и периодонтальной связки многообещающие результаты демонстрируют индуцированные человеком плюрипотентные стволовые клетки [11], эндотелиальные клетки пупочной вены человека, перициты, стволовые клетки жировой ткани [12]. Последние могут быть применены как в виде монолечения, так и в составе ткане-инженерных конструкций на основе какого-либо гидрогеля, каркаса из коллагена, хитозана, полимолочной кислоты. Для регенерации цемента были изучены фактора роста, выделенные собственно из цемента, белка прикрепления цемента и белка цемента-1 [13].
В последнее время большое внимание стоматологов привлекает пародонтотерапия с использованием излучения лазера – так называемая пародонтальная фототерапия. Важно отметить, что, поскольку лазерное облучение может способствовать пролиферации эндотелиальных клеток сосудов и дифференцировке остеобластов, клеток периодонтальной связки и цементобластов, пародонтальная фототерапия может быть рассмотрена в качестве вспомогательной регенеративной терапии тканей пародонта [14].
ПРЕПАРАТЫ «СФЕРО®ДЕНТ» ПРИ ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЯХ ПАРОДОНТА
Поскольку инъекционные имплантируемые гели «Сферо®ГЕЛЬ» производства АО «БИОМИР сервис» (относящиеся к классу биомиметиков внеклеточного матрикса с хорошей биосовместимостью и высокими биостимулирующими свойствами [15]) зарекомендовали себя в медицине, в частности в косметологии, как способные запустить механизмы физиологической регенерации собственных тканей организма, было предложено исследовать возможности препаратов «Сферо®ДЕНТ» («Сферо®ГЕЛЬ» для стоматологии) в регенерации внеклеточного матрикса десен, подвергающегося дистрофии.
Приводим клинический случай регенеративной терапии у пациентки с хроническим пародонтитом, результаты которой позволили подготовить пораженные ткани к ортодонтическому лечению.
Пациентка М., 36 лет. Обратилась с жалобами на кровоточивость и болезненные ощущения при чистке зубов, чувство дискомфорта при смыкании зубов и искривление передней группы зубов на нижней челюсти.
Из анамнеза: впервые обратила внимание на появление отдельных симптомов 6 лет назад. За стоматологической помощью в поликлинику по месту жительства обращалась периодически для осмотра и профессиональной гигиены полости рта. Мероприятия по уходу осуществляет регулярно дома с применением зубной щетки и паст различных производителей. За последние 2 года отметила нарастание симптоматики. Хронические сопутствующие заболевания отрицает.
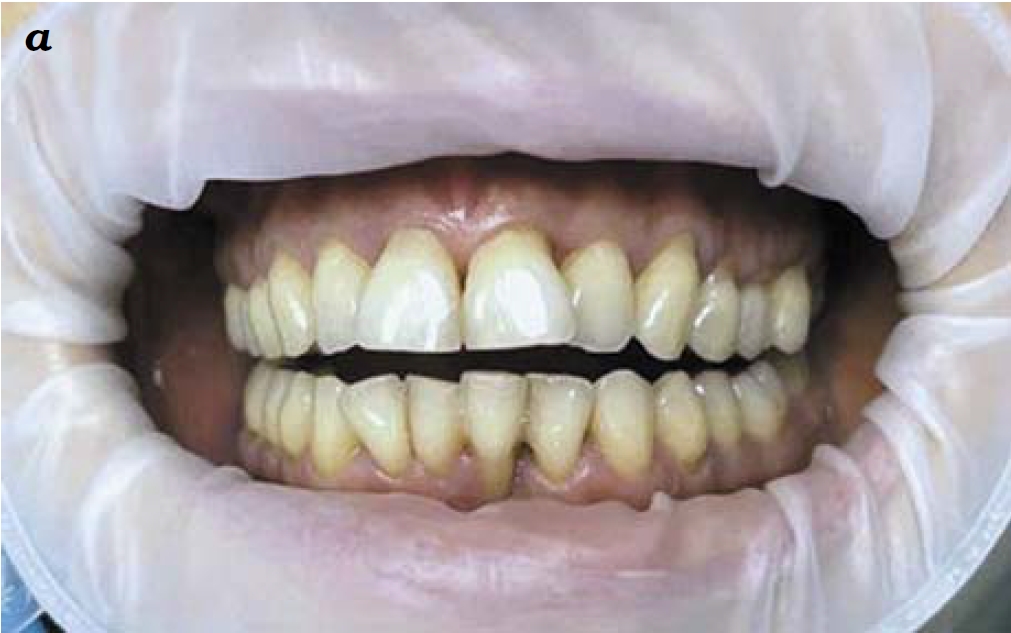
При осмотре признаки нарушения открывания рта и артикуляции не выявлены. Красная кайма губ не изменена. Лимфатические узлы головы и шеи не увеличены, болезненности в зонах их пальпации нет. Слизистая оболочка губ, щек, твердого и мягкого нёба неравномерного бледно-розового цвета с незначительным отеком, влажная. Прикрепление уздечек губ и языка низкое. Тяжи слизистой оболочки преддверия рта в норме. Десны переднего края фронтальной группы зубов верхней и нижней челюсти гиперемированы, отечные. При надавливании в области десневой борозды фронтальной группы зубов на обеих челюстях обнаружены признаки контактной кровоточивости, появляющиеся через несколько секунд. Индекс кровоточивости Мюллеманна (в модификации Коуэлла) – 2. Целостность эпителиального прикрепления нарушена. Содержимое пародонтальных карманов 12, 22, 33, 43, 42, 41, 32-го зубов серозное; 31-го зуба – экссудативно-гнойное. Глубина пародонтальных карманов в области 15, 13, 12, 21, 22, 23-го зубов около 4 мм; в области 11, 31, 42, 26-го зубов – около 6 мм. Множественные признаки рецессии десен в области 12, 11, 21, 22, 32, 31, 42, 42, 14, 24, 26, 34, 44-го зубов величиной до 1,5–2 мм (рис. 1а). Язык розового цвета, с желто-белым налетом по спинке и у корня.
На момент осмотра признаки кариозного поражения зубов не выявлены. Пломбы на 16, 37, 14, 15, 36, 46-м зубах не нарушены. Патологическая подвижность 31, 42-го зубов по шкале Миллера в модификации Флезара – 2-го класса. Выявлены фуркационные дефекты в области 26, 46, 31-го зубов. Прикус ортогнатический. Признаки скученного положения резцов обеих челюстей. Супраконтакты зафиксированы в области 13, 14, 33, 43, 26, 37-го зубов, что соответствует 3-му классу по Дженкельсону. Мягкие и твердые над- и поддесневые зубные отложения – в области 34–44-го зубов. Индекс Силнес – Лоэ –1.
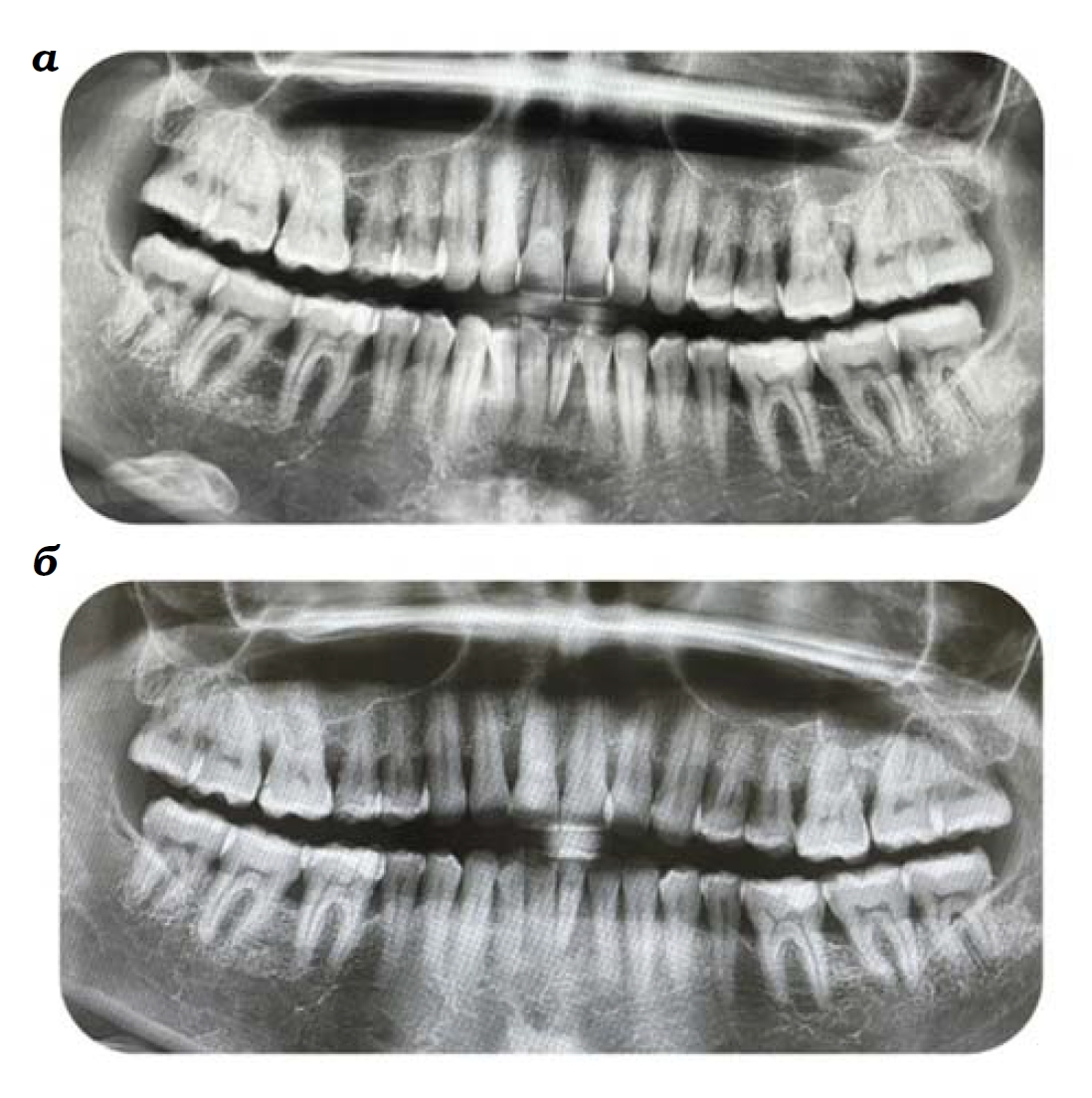
Для уточнения диагноза и составления плана лечения проведено рентгенологическое исследование – ортопантомография (ОПТГ), – результаты которого показали снижение высоты межальвеолярной перегородки от 1/3 до 1/2 длины корня, признаки вертикальной резорбции и деструкции кортикальной пластины за счет выраженных явлений остеопороза – повышения рентгенопрозрачности кости, смазанности структуры костных трабекул, наличия костных карманов (ниш остеорезорбции). Рисунок зоны остеопорозного поражения без резких границ переходит в нормальную кость. Тип костной ткани – D2 (Lekholm et Zalb, 1985) (рис. 2а).
Лечение
Учитывая признаки хронического генерализованного пародонтита средней степени тяжести, на первом этапе была выполнена профессиональная аппаратная гигиена полости рта с помощью ультразвукового скалера NSK varios 970 в сочетании с ручным кюретажем. Пациентке рекомендованы: тщательное соблюдение гигиены полости рта дважды в день с применением ирригатора; ротовые ванночки с лекарственным веществом из группы нестероидных противовоспалительных средств дважды в день в течение двух недель, для локального нанесения – лечебно-профилактическое средство, содержащее бактериофаги.
На повторном приеме через 14 дней пациентка отметила изменения, оцененные ею как положительные. При осмотре дёсны вдоль переднего края фронтальной группы зубов верхней и нижней челюсти неравномерно розовые. При надавливании в области десневой борозды фронтальной группы зубов на обеих челюстях признаки контактной кровоточивости не выявлены. Индекс кровоточивости Мюллеманна (в модификации Коуэлла) – 0. Целостность эпителиального прикрепления нарушена. Содержимое пародонтальных карманов 12, 22, 33, 43, 42, 41, 31 и 32-го зубов – незначительное серозное. Глубина пародонтальных карманов около 4 мм в области 15, 13, 12, 21, 22 и 23-го зубов; в области 11, 31, 42, 26-го зубов – около 6 мм. Индекс Силнес – Лоэ – 0. Осуществлено шинирование фронтальных зубов нижней челюсти керамической лентой GlasSpan.
К регенеративной терапии композициями «Сферо®ДЕНТ» в вариантах Light и Medium приступили через месяц после шинирования. Общая длительность курса биорегенерации составила 3,5 месяца. На первом и втором приеме с интервалом одна неделя осуществлено инфильтрационное введение препарата «Сферо®ДЕНТ Light» из шприца фирмы-производителя иглой 27 G в 5–6 точек под слизистую оболочку переходных складок десен верхней и нижней челюсти в проекции фронтальной группы зубов в объеме 0,5 мл на точку. На третьем и четвертом приеме, также с интервалом одна неделя
нижней челюсти в объеме 1,0 мл на точку (игла 27 G). В дальнейшем с интервалом 7–9 дней продолжили инфильтрационное введение только «Сферо®ДЕНТ Light»: в 5–6 точек по переходной складке слизистой оболочки десен обеих челюстей в объеме 1,0 мл на точку (игла 27 G).
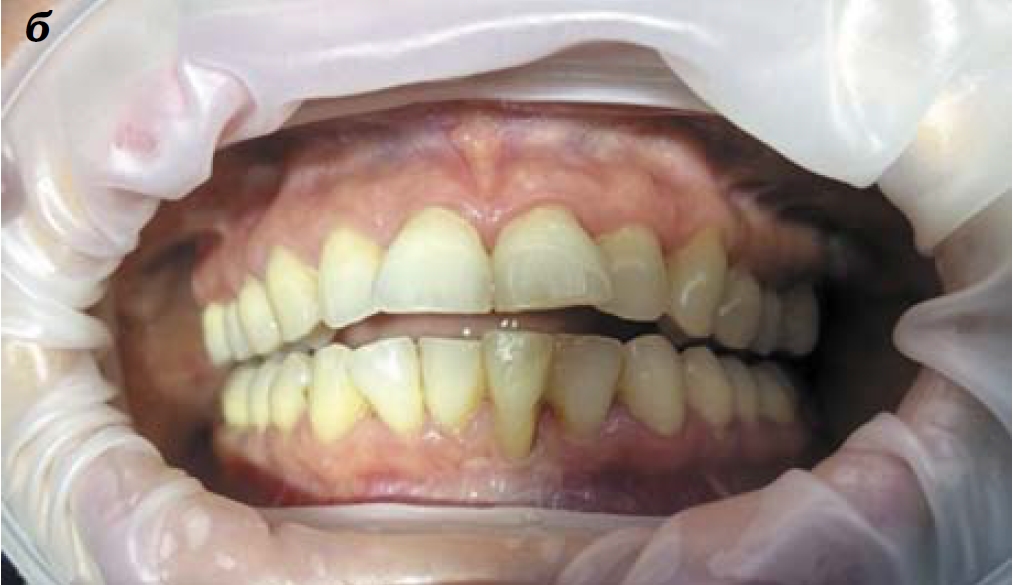
Через 2,5 месяца от начала регенеративной терапии вместе с качественным изменением состояния слизистой оболочки десны у пациентки отметили значимое увеличение объема десен и сокращение глубины пародонтальных карманов до 2,5 мм, а рецессии зубов 14, 15, 12, 22, 33, 32 и 42-го – до 4,5 мм (рис. 1б). На контрольной ОПТГ высота межальвеолярной перегородки остается прежней. Границы разрушенных альвеолярных краев начинают контурироваться более отчетливо, уменьшаются очаги остеопороза (рис. 2б).
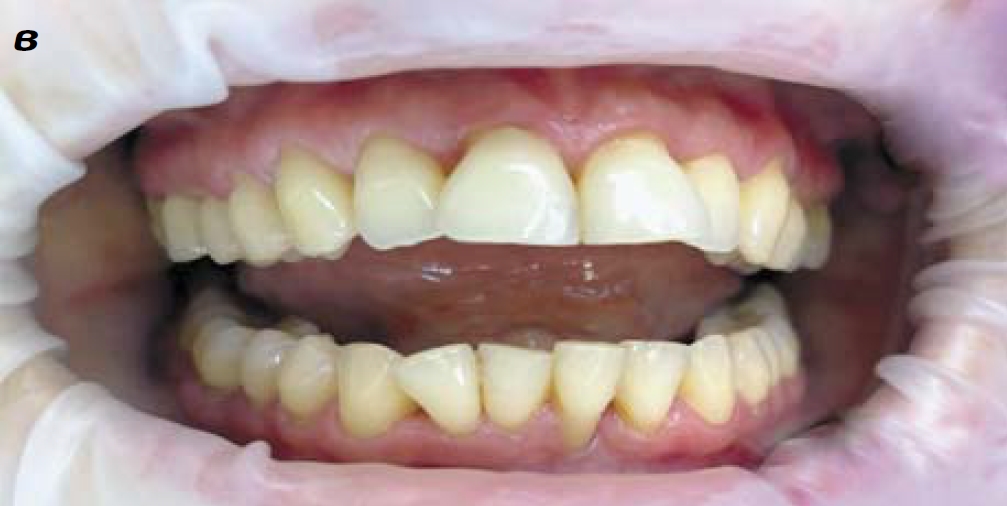
Результаты регенеративной терапии пародонта пациентка оценивает положительно. Наряду с разрешением большей части симптомов отмечает эстетические изменения со стороны мягких тканей полости рта (рис. 1в). На повторной консультации ортодонта после окончания регенеративного лечения пациентке рекомендовано продолжить наблюдение у пародонтолога. При отсутствии признаков обострения хронического пародонтита в течение 6 месяцев будет произведена установка брекетсистемы.
Рис. 1. Динамика состояния слизистой оболочки десен пациентки М. с хроническим генерализованным пародонтитом при регенеративной терапии препаратами «Сферо®ДЕНТ». Вид до начала лечения (а); через 2,5 месяца (б) и по окончании курса терапии (через 3,5 месяца после начала регенеративной терапии)
Рис. 2. ОПТГ пациентки М. с хроническим генерализованным пародонтитом до начала лечения (а); после курса стандартной терапии и 2,5 месяцев регенеративной терапии различными формами «Сферо®ДЕНТ»
ОБСУЖДЕНИЕ
Исследования последних лет позволили иначе взглянуть на патогенез заболеваний пародонта, причины разрушения связочного аппарата зубов и костной ткани альвеолярного отростка.
Бактерии в полости рта организованы в структуры, известные как биопленки, представляющие собой сложную защитную систему, погруженную во внеклеточный матрикс [16]. В зависимости от воздействия внутренних и внешних факторов микробиом полости рта постоянно эволюционирует, благодаря чему происходят дифференцировка и созревание клеток слизистой оболочки хозяина, развитие его иммунной системы и защита от инвазии и роста чужеродных и потенциально вредных микроорганизмов [17]. В микробиоме ротовой полости здорового человека преобладают бактерии Firmicutes, Proteobacteria, Actinobacteria, Bacteroidetes, Fusobacteria и Spirochaetes, а также некоторые грибы, включая Candida, Cryptococcus, Fusarium, Aspergillus и др. [18]. Тем не менее изменения в микробном разнообразии между здоровым и патологически измененным пародонтом остаются спорными [19].
Заболевания пародонта связаны с некоторыми особенностями иммуновоспалительного ответа хозяина, который сначала характеризуется физиологической реакцией острого воспаления (гингивитом), поддерживаемой клетками врожденной иммунной системы, включая резидентные клетки (эпителиальные клетки и фибробласты), фагоцитирующие клетки (макрофаги и нейтрофилы), белки комплемента и нейропептиды. В этой фазе цитокины, продуцируемые популяцией резидентных клеток, таких как фактор некроза опухоли-α, интерлейкин-1β и интерлейкин-6, выполняют основную функцию, стимулируя миграцию клеток к очагам инфекции и усиливая экспрессию молекул адгезии нейтрофилов на внутренней поверхности сосудов и увеличение синтеза других провоспалительных цитокинов [20].
Устранение зубных наложений приводит к прогрессирующему разрешению воспаления и восстановлению индивидуального гомеостаза ротовой полости. Их наличие приводит к активации приобретенного иммунитета. Это событие происходит путем процессинга и презентации антигенов лимфоцитами, макрофагами и дендритными клетками и регулируется цитокинами адаптивного иммунитета, включая интерферон-γ, интерлейкин-2, интерлейкин-4. Прогрессирующая деструкция тканей пародонта приводит к резорбции костной ткани и деградации внеклеточного матрикса – основы связочного аппарата зуба. Резорбция кости возникает в результате смещения баланса между остеогенезом и остеокластогенезом в пользу второго.
Деградация внеклеточного матрикса происходит из-за активации ферментов, известных как матриксные металлопротеиназы (ММП). Они обычно характеризуются низким уровнем экспрессии в здоровых тканях пародонта, а при пародонтите осуществляют деградацию десны и периодонтальной связки [21]. Примечательно, что только активные формы этих ферментов способны действовать деструктивно [22]. Специфическая терапия, направленная на ингибирование активности металлопротеаз, может стать потенциальной терапевтической стратегией при лечении пародонтита или устранении его последствий. Это в дополнение к стандартным методам лечения, несомненно, сможет улучшить результаты и прогноз заболевания.
Перспективным направлением для стимуляции регенерации тканей является применение многокомпонентных биополимерных миметиков внеклеточного матрикса. К ним относится «Сферо®ДЕНТ» – биополимерный микрогетерогенный коллагенсодержащий гидрогель [23].
Применение препаратов «Сферо®ДЕНТ» способствует васкуляризации тканей в области дефекта и их восстановлению без образования грубой волокнистой ткани (рубца) [24].
ЗАКЛЮЧЕНИЕ
В рассматриваемом клиническом случае у пациентки М. в целях неспецифического ингибирования активности металлопротеаз и регенеративного восстановления тканей пародонта были применены различные формы гетерогенного микроструктурированного гидрогеля на основе гидролизата коллагена «Сферо®ДЕНТ» («Сферо®ГЕЛЬ» для стоматологии). Это позволило создать условия для направленной регенерации мягких и опорных тканей десен, улучшить трофические процессы, что положительно было оценено как пациенткой, так и лечащим врачом.
И. Егиазарова, кандидат медицинских наук, врач-стоматолог, пародонтолог, хирург клиники «Май»,
Москва, Россия
ЛИТЕРАТУРА
- Lindhe J, Karring T, Lang N, eds. Clinical periodontology andimplant dentistry. 4th edn. – Munskgaard: Blackwell, 2003:3–48.
- Brill N, Krasse B. The passage of tissue fluid into the clinicallyhealthy gingival pocket. // Acta Odont Scand, 1958;16:233–24.
- Chapple ILC, Bouchard P, Cagetti MG, et al. Interaction of lifestyle, behaviour or systemic diseases with dental caries and periodontal diseases: Consensus report of group 2 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. // J Clin Periodontol, 2017;44(Suppl. S18):S39–S51.
- Popa GV, Costache A, Badea O, et al. Histopathological and immunohistochemical study of periodontal changes in chronic smokers. // Romanian J Morphol Embryol, 2021;62:209–217.
- Kuo L-C, Polson AM, Kang T. Associations between periodontal diseases and systemic diseases: A review of the inter-relationships and interactions with diabetes, respiratory diseases, cardiovascular diseases and osteoporosis. // Public Health, 2008;122:17–433.
- Светлакова ЕН, Семенцова ЕА, Полушина ЛГ и др. К вопросу диагностики пародонтита: существующие возможности и клинические потребности. // Здоровье и образование в XXI веке, 2017;(3). https://cyberleninka.ru/article/n/kvoprosu-diagnostiki-parodontita-suschestvuyuschievozmozhnosti-i-klinicheskie-potrebnosti.
- Клинические рекомендации (протоколы лечения) при диагнозе «пародонтит». Утверждены «Стоматологической ассоциацией России» 23.04.2023 с изменениями и дополнениями на основании Постановления №15 Совета «Стоматологической ассоциации России» от 30.09.2014. https://estomatology.ru/director/protokols/.
- Anushi M, Suresh K. Periodontal bone regeneration in intrabony defects using osteoconductive bone graft versus combination of osteoconductive and osteostimulative bone graft: A comparative study. // Dent Res J, 2015;12:25–30.
- Zhou M, Geng Y-M, Li S-Y, et al. Nanocrystalline hydroxyapatite-based scaffold adsorbs and gives sustained release of osteoinductive growth factor and facilitates bone regeneration in mice ectopic model. // J Nanomater, 2019;2019:10.
- Chen M, Xu Y, Zhang T, et al. Mesenchymal stem cell sheets: A new cell-based strategy for bone repair and regeneration. // Biotechnol Lett, 2019;41:305–318.
- Zhang C, Hu K, Liu X, et al. Novel hipsc-based tri-culture for pre-vascularization of calcium phosphate scaffold to enhance bone and vessel formation. // Mater Sci Eng C, 2017;79:296–304.
- Mohammed E, Khalil E, Sabry D. Effect of adiposederived stem cells and their exo as adjunctive therapy to nonsurgical periodontal treatment: A histologic and histomorphometric study in rats. // Biomolecules, 2018;8:167.
- Arzate H, Zeichner-David M, Mercado-Celis G. Cementum proteins: Role in cementogenesis, biomineralization, periodontium formation and regeneration. // Periodontology-2000, 2015;67:211–233.
- Севастьянов ВИ, Перова НВ. Биополимерный гетерогенный гидрогель «Сферо®ГЕЛЬ» – инъекционный биодеградируемый имплантат для заместительной и регенеративной медицины. // Практическая медицина, 2014;8(84):120–126.
- Ohsugi Y, Niimi H, Shimohira T, et al. In Vitro Cytological Responses against Laser Photobiomodulation for Periodontal Regeneration. // Int J Mol Sci, 2020;21:9002.
- Basavaraju M, Sisnity V, Palaparthy R, et al. Quorum quenching: Signal jamming in dental plaque biofilms. // J Dent Sci, 2016;11:349–352.
- Nearing JT, DeClercq V, Van Limbergen J, et al. Assessing the Variation within the Oral Microbiome of Healthy Adults. // mSphere, 2020;5:e00451–20.
- Leonardi R, Almeida LE, Trevilatto P, et al. Occurrence and regional distribution of TRAIL and DR5 on temporomandibular joint discs: Comparison of disc derangement with and without reduction. // Oral Surg Oral Med Oral Pathol Oral Radiol, 2010;109:244–251.
- Radaic A, Kapila YL. The oralome and its dysbiosis: New insights into oral microbiome-host interactions. // Comput Struct Biotechnol J, 2021;19:1335–1360.
- Cekici A, Kantarci A, Hasturk H, et al. Inflammatory and immune pathways in the pathogenesis of periodontal disease. // Periodontology-2000, 2014;64:57–80.
- Checchi V, Maravic T, Bellini P, et al. The Role of Matrix Metalloproteinases in Periodontal Disease. // Int J Environ Res Public Health, 2020;17:4923.
- Kraft-Neumärker M, Lorenz K, Koch R, et al. Full-mouth profile of active MMP-8 in periodontitis patients. // J Periodontal Res, 2012;47:121–128.
- Севастьянов В.И., Перова Н.В., Басок Ю.Б., Немец Е.А. Биомиметики внеклеточного матрикса в тканевой инженерии и регенеративной медицине для травматологии и ортопедии. Opinion Leader. 2020; 6(35):36–46.
- Соловьева ИВ, Перова НВ, Севастьянов ВИ. Возможности применения биополимерного микрогетерогенного коллагенсодержащего геля при травмах и заболеваниях опорно-двигательного аппарата. Современная медицина. 2016;(2):66-69
- Pashley D, Tay F, Yiu C, et al. Collagen degradation by host-derived enzymes during aging. // J Dent Res, 2004;83:216–221.